Oxigeno sobre elementos
Con este material conocerás cómo interactúa el oxígeno ante los metales y no metales para la formación de hidróxidos y ácidos.
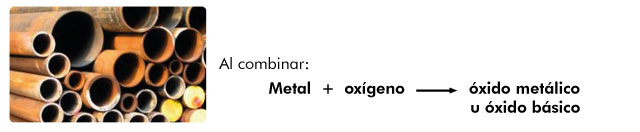
Dicho proceso, conocido como oxidación, lo podemos observar en las tuberías, en la herrería y es relevante en las industrias de la construcción y marítima. La oxidación también tiene que ver con la combustión que usas a diario al calentar alimentos en la estufa ó el agua para bañarte, así como la que ocurre en el motor de los automóviles y, en la síntesis de algunos medicamentos.
Reacciones de oxígeno
El oxígeno es el elemento más abundante en el planeta Tierra, constituye aproximadamente el 50% en masa de la corteza terrestre y forma el 21% en volumen de la atmósfera.
Todo fenómeno químico puede ser representado a través de una ecuación química , que nos muestra los cambios que se llevan a cabo.
Reacción con metales
las reacciones del oxígeno con un metal, es la que ocurre con el magnesio al someterlo a la reacción de oxidación en una flama, pues desprende una intensa luz blanca y se convierte en un sólido blanco muy frágil; el producto de esta reacción es un óxido metálico llamado óxido de magnesio.
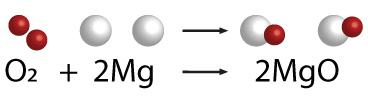
Reacción con no metales
Reacciones de óxido con agua
los óxidos metálicos como no metálicos, es factible combinarlos con agua para formar nuevos compuestos. En el caso de los óxidos metálicos cuando interactúan con agua forman hidróxidos.
Ejemplo del magnesio:
El óxido de magnesio en presencia de agua forma el hidróxido de magnesio.
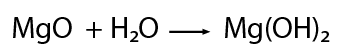
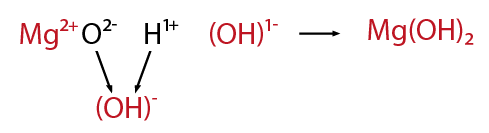
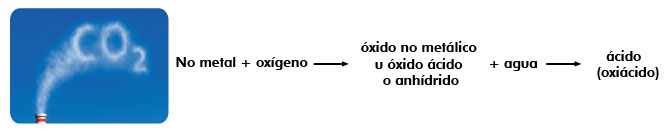
Los óxidos no metálicos en presencia de agua forman ácidos del tipo oxácido.
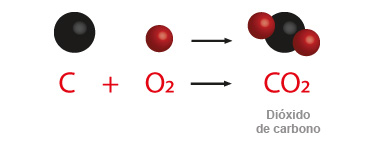
Por ejemplo en el dióxido de carbono o anhídrido carbónico al reaccionar con agua, produce una molécula de ácido carbónico.

Observa que sólo se suman la cantidad de elementos que intervienen en la síntesis de los ácidos, empezando por la calidad ácido representado por los hidrógenos, después el no metal y finalmente la cantidad de oxígenos que intervienen en la esquematización simbólica de la reacción para formar ácidos.
Ejemplo del magnesio:
El óxido de magnesio en presencia de agua forma el hidróxido de magnesio.
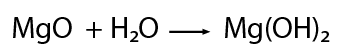

Por ejemplo en el dióxido de carbono o anhídrido carbónico al reaccionar con agua, produce una molécula de ácido carbónico.
















Reglas de nomenclatura
La nomenclatura química es un conjunto de reglas que se aplican para nombrar y representar con símbolos y fórmulas a los elementos y compuestos químicos. Actualmente se aceptan tres sistemas de nomenclatura donde se agrupan y nombran a los compuestos inorgánicos:
- Sistema de nomenclatura estequimétrico ó sistemático de la Unión Internacional de Química Pura y Aplicada, (IUPAC).
- Sistema de nomenclatura funcional, clásico ó tradicional.
- Sistema de nomenclatura Stock.
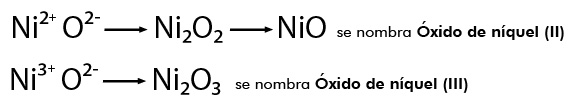
Óxidos metálicos
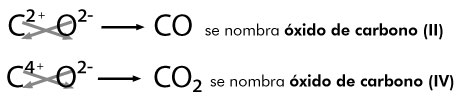
Óxidos ácidos
Hidróxidos
¿Cómo se forman y nombran los hidróxidos?
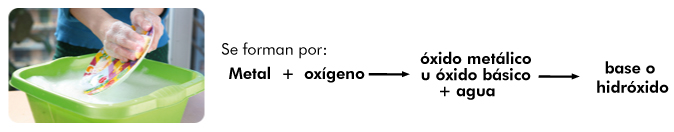
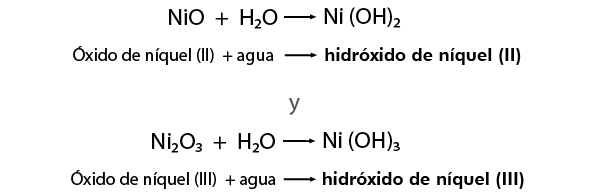
Se conserva la misma nomenclatura para nombrar a los compuestos derivados de los óxidos metálicos formando los hidróxidos correspondientes y también se conservan los sufijos “oso” para el valor menor de la valencia e “ico” para el valor mayor, por ejemplo:

Se conserva la misma nomenclatura, es decir, considerando la cantidad de elementos que constituyen el compuesto, por ejemplo:

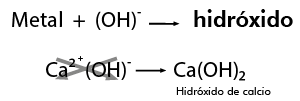
Cuando se tiene un óxido no metálico, al combinarse con agua forma un ácido de tipo oxiácido, se llaman oxiácidos porque en su composición está presente el oxígeno y la calidad ácida será determinada por la presencia del hidrógeno.
Se nombra al no metal con el sufijo ato, seguida del valor de la valencia del no metal y por último se agrega de hidrógeno.
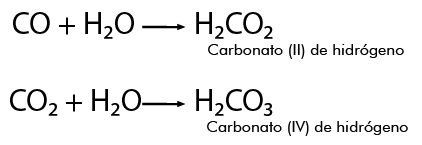
Por ejemplo, para formar los ácidos correspondientes del carbono, se parte de su óxido o anhídrido en presencia de agua, reaccionan y se produce:

Se conserva la misma nomenclatura, es decir, considerando la cantidad de elementos que constituyen el compuesto, por ejemplo:

| N2O5 | anhídrido nítrico | óxido de nitrógeno (v) | pentaóxido de dinitrógeno |
| FeO | óxido ferroso | óxido de hierro (II) | monóxido de fierro |
| HClO | ácido hipocloroso | clorato (I) de hidrógeno | monoxoclorato de hidrógeno |
| Al2O3 | óxido alumínico | óxido de aluminio | trioxido de dialuminio |
| Co2O3 | óxido cobáltico | óxido de cobalto (II) | trióxido de dicobalto |
| H2SO4 | ácido sulfúrico | sulfato (VI) de hidrógeo | teraososulfato (VI) de hidrógeno |
| Na2O | óxido sódico | óxido de sodio | óxido de disodio |
| Ba(OH)2 | hidróxido de barico | hidróxido de bario | hidróxido de bario |
| I2O5 | anhídrido yódico | óxido de yodo (V) | pentaóxido de diyodo |
| HBr | ácido bromhídrico | ácido bromhídrico | bromuro de hidrogeno |
Balanceo
El balanceo consiste en igualar el número de átomos de cada elemento tanto en los reactivos como en los productos, y sirve para verificar la Ley de la Conservación de la Materia.
Para escribir y balancear una ecuación química de manera correcta, es necesario tener presente las siguientes recomendaciones:
- Revisar que la ecuación química esté completa y correctamente escrita.
- Observar si se encuentra balanceada.
- Balancear primero los metales, los no metales y al final el oxígeno y el hidrógeno presentes en la ecuación química.
- Escribir los números requeridos como coeficiente al inicio de cada compuesto.
- Contar el número de átomos multiplicando el coeficiente con los respectivos subíndices de las fórmulas y sumar los átomos que estén de un mismo lado de la ecuación.
- Verificar el balanceo final y reajustar si es necesario.
- A continuación veremos los pasos a seguir para que realices un balanceo de ecuaciones químicas.
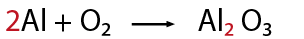
- Observa que la ecuación química esté completa y bien escrita.

 Contar el número de elementos existentes en dicha ecuación de lado de los reactivos y del lado de los productos, empezando por: metales, no metales, dejando para el final al oxígeno e hidrógeno.
Contar el número de elementos existentes en dicha ecuación de lado de los reactivos y del lado de los productos, empezando por: metales, no metales, dejando para el final al oxígeno e hidrógeno.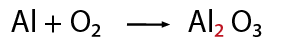
 Al hacer el conteo de cada lado, se recomienda indicar con coeficientes la igualación de la cantidad de átomos de los elementos que intervienen en la representación de una reacción química, por ejemplo:
Al hacer el conteo de cada lado, se recomienda indicar con coeficientes la igualación de la cantidad de átomos de los elementos que intervienen en la representación de una reacción química, por ejemplo: 
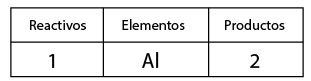
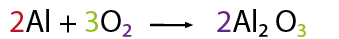
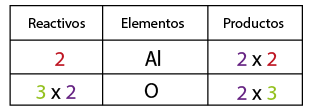
 A continuación contar el no metal, oxígeno de ambos lados de la ecuación, por inspección se observa que del lado de los reactivos se requiere un coeficiente tres y de dos en el compuesto óxido de aluminio con el fin de igualar la cantidad de oxígenos.
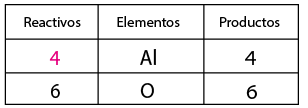
A continuación contar el no metal, oxígeno de ambos lados de la ecuación, por inspección se observa que del lado de los reactivos se requiere un coeficiente tres y de dos en el compuesto óxido de aluminio con el fin de igualar la cantidad de oxígenos. Se contabiliza nuevamente el aluminio, observando que se alteró en cantidad de átomos de este elemento, por lo que ahora es necesario tener cuatro aluminios del lado de los reactivos en lugar de dos, con el fin de equilibrar la cantidad de átomos del elemento aluminio en reactivos y en productos.
Se contabiliza nuevamente el aluminio, observando que se alteró en cantidad de átomos de este elemento, por lo que ahora es necesario tener cuatro aluminios del lado de los reactivos en lugar de dos, con el fin de equilibrar la cantidad de átomos del elemento aluminio en reactivos y en productos.
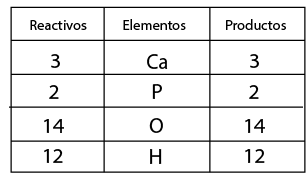
Balanceo de un fenómeno de neutralización
En este caso una que representa un fenómeno de neutralización, es decir, reacciona un ácido y una base, para formar una sal y agua.- Observar que la ecuación química esté completa y bien escrita.
- Contar el número de elementos existentes en dicha ecuación del lado de los reactivos y después los correspondientes a los productos, empezando por: metales, no metales, dejando para el final al oxígeno e hidrógeno.
- Al hacer el conteo de cada lado, se recomienda indicar con coeficientes la igualación de la cantidad de átomos de los elementos que intervienen en la representación de una reacción química.













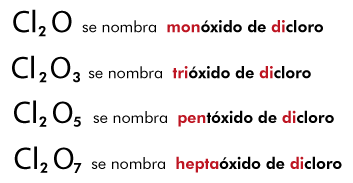




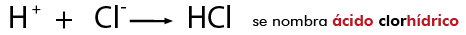






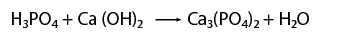

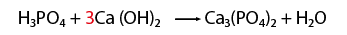

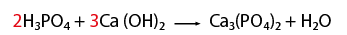

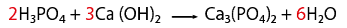

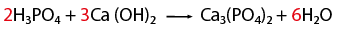




No hay comentarios:
Publicar un comentario