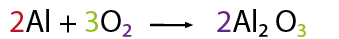
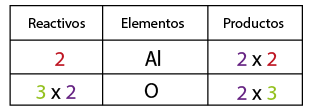
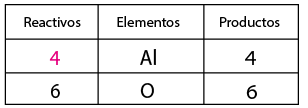
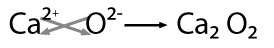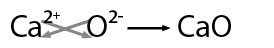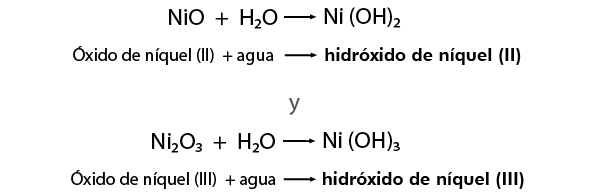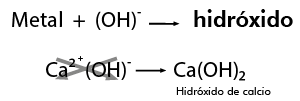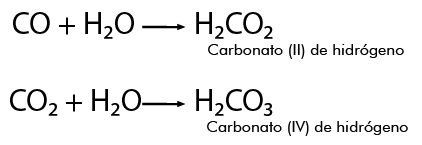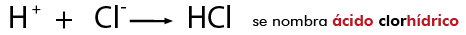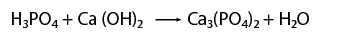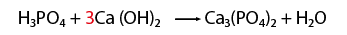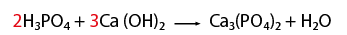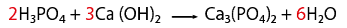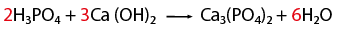Enlace Iónico
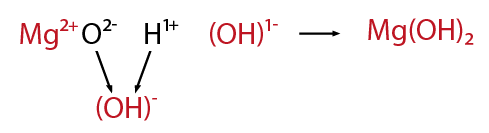
Es la unión que resulta de la presencia de fuerzas de atracción electrostática entre los iones de distinto signo. Se da cuando uno de los átomos capta electrones del otro.
Este enlace se produce cuando átomos de elementos metálicos (especialmente los situados más a la izquierda en la tabla periódica -períodos 1, 2 y 3) se encuentran con átomos no metálicos (los elementos situados a la derecha en la tabla periódica -especialmente los períodos 16 y 17).
En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos y negativos, respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. Estas fuerzas eléctricas las llamamos enlaces iónicos.
Ejemplos:
- NaCl (cloruro de sodio)
- KCl (cloruro de sodio)
- KI (ioduro de potasio)
- CaCl2 (cloruro de calcio)
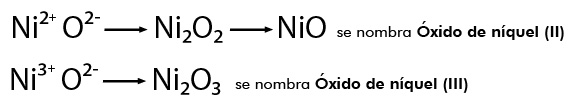
- FeO (óxido de hierro (II))
- MnO2 (manganesa)
- Li3N (nitruro de litio)
- CaC2 (acetiluro de calcio)
- Ca3P2 (fosfuro de calcio)
- AgCl (cloruro de plata)
Propiedades:
• Son sólidos de estructura cristalina en el sistema cúbico.
• Altos puntos de fusión (entre 300 °C o 1000 °C)2 y ebullición.
• Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
• Son solubles, como en agua y otras disoluciones acuosas.
• Una vez fundidos o en solución acuosa, sí conducen la electricidad.
En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla del circuito se encenderá. Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello éste funciona.
Unión y red cristalina:
La unión es posible gracias a la fuerza de atracción entre las cargas positivas y las cargas negativas que se forman
Una red cristalina, depende de lo siguiente:
Tamaño de los iones.- El valor del radio de los iones marcará la distancia a la que se pueden situar por una simple cuestión de espacio. En el caso de redes cuyos tamaños iónicos son más semejantes, los iones se pueden rodear de un mayor número de iones de carga opuesta, y esta red iónica presenta coordinación (8,8), que es la llamada cúbica centrada en el cuerpo.
Carga de los iones.- Como el cristal es eléctricamente neutro, si los iones tienen carga distinta esto condicionará la estequiometría y, por tanto, la estructura y el índice de coordinación.
Cuando se funden se liberan de sus posiciones fijas:
Son sólidos muy duros porque las fuerzas electrostáticas que unen los iones son grandes, pero también son frágiles, ya que, al haber un ordenamiento tan perfecto en la red, pequeños desplazamientos de los iones hacen que las fuerzas que antes eran de atracción pasen a ser de repulsión, por lo que el sólido se rompe.
En otras palabras, los iones tienen posiciones fijas y carecen de movilidad, pero, al fundirse o disolverse en agua, se desmorona la red cristalina quedando los iones en libertad, por lo que estos compuestos fundidos o disueltos conducen la electricidad.
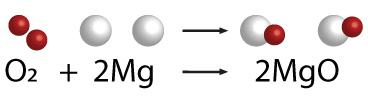
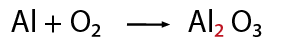
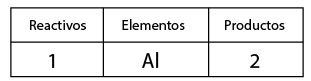
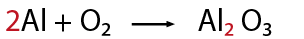
El sodio es un elemento metálico solido que al reaccionar con cloro gaseoso produce una reacción exotérmica formando un precipitado de cloruro de sodio o sal común.
Enlace Covalente
Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...).
Ejemplos:
Temperaturas de fusión y ebullición bajas.
En condiciones ordinales (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos
Son blandos en estado sólido.
Aislantes de corriente eléctrica y calor.
Solubilidad. Las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (semejante disuelve a semejante).
Enlace covalente polar o puro
Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble. Se forman así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por enlaces covalentes.
Ejemplos:
- H2 (gas dihidrógeno)
- O2 (gas oxígeno)
- Cl2 (gas cloro)
- Br2 (bromo elemental)
- N2 (gas nitrógeno)
- CH4 (metano)
- C2H6 (etano)
- S8 (azufre rómbico)
- P4 (fósforo blanco)
- NF3 (fluoruro de nitrógeno)
Enlace covalente polar o puro
Cuando los átomos son distintos, los electrones compartidos no serán atraídos por igual, de modo que estos tenderán a aproximarse hacia el átomo más electronegativo, es decir, aquel que tenga una mayor apetencia de electrones. Este fenómeno se denomina polaridad (los átomos con mayor electronegatividad obtienen una polaridad más negativa, atrayendo los electrones compartidos hacia su núcleo), y resulta en un desplazamiento de las cargas dentro de la molécula.
Se podría decir que al átomo más electronegativo no le gusta mucho compartir sus electrones con los demás átomos, y en el caso más extremo, deseará que el electrón le sea cedido sin condiciones formándose entonces un enlace iónico, de ahí que se diga que los enlaces covalentes polares tienen, en alguna medida, carácter iónico.
Ejemplos:
- Metano CH4
- Aminas CH3-NH-CH3
- Amoniaco NH3
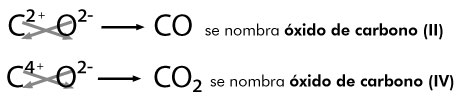
- Dióxido de carbono CO2
- Oxido nitroso N2O
- Oxido nítrico NO
Características:
- Enlace sencillo ó simple: se comparten 2 electrones de la capa de valencia.
- Enlace doble: se comparten cuatro electrones, en dos pares, de la capa de valencia.
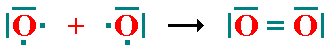
- Enlace triple: se comparten 6 electrones de la capa de valencia en 3 pares.
- Enlace cuádruple: es la unión de 8 electrones de la capa de valencia en 4 pares .
- Enlace quíntuple: es la unión de 10 electrones de la capa de valencia en 5 pares.
Enlace covalente no polar
Cuando un mismo átomo aporta el par electrónico el enlace covalente formado es coordinado o dativo. Aunque las propiedades de enlace covalente coordinado son parecidas a las de un enlace covalente normal (dado que todos los electrones son iguales, sin importar su origen), la distinción es útil para hacer un seguimiento de los electrones de valencia y asignar cargas formales. Una base dispone de un par electrónico para compartir y un ácido acepta compartir el par electrónico para formar un enlace covalente coordinado. Un átomo no completa la regla del octeto.
- Se forma entre átomos iguales o diferentes, y la diferencia de electronegatividad debe ser cero o muy pequeña (menor que 0,4).
- En este enlace, los electrones son atraídos por ambos núcleos con la misma intensidad, generando moléculas cuya nube electrónica es uniforme.